Tofacitinib citrate er et reseptbelagt medikament (varenavn Xeljanz) opprinnelig utviklet av Pfizer for en klasse orale Janus kinase (JAK)-hemmere. Det kan selektivt hemme JAK-kinase, blokkere JAK/STAT-veier, og dermed hemme cellesignaltransduksjon og relatert genuttrykk og aktivering, brukt til å behandle revmatoid artritt, psoriasisartritt, ulcerøs kolitt og andre immunsykdommer.
Legemidlet inkluderer tre doseringsformer: tabletter, tabletter med forsinket frigjøring og orale løsninger. Tablettene ble først godkjent av FDA i 2012, og doseringsformen med vedvarende frigivelse ble godkjent av FDA i februar 2016. Den er den første som behandler revmatoide ledd. Yan er en JAK-hemmer tatt oralt en gang om dagen. I desember 2019 ble en ny indikasjon for medikamenter med vedvarende frigivelse godkjent igjen for moderat til alvorlig aktiv ulcerøs kolitt (UC). I tillegg er de nåværende fase 3 kliniske studiene for plakkpsoriasis fullført, og ytterligere seks fase 3 kliniske studier pågår, som involverer aktiv psoriasisartritt, juvenil idiopatisk artritt, etc. Slags indikasjoner. Fordelene med depottabletter som er langtidsvirkende og som bare må tas en gang om dagen, bidrar til å håndtere og kontrollere pasientens sykdommer.
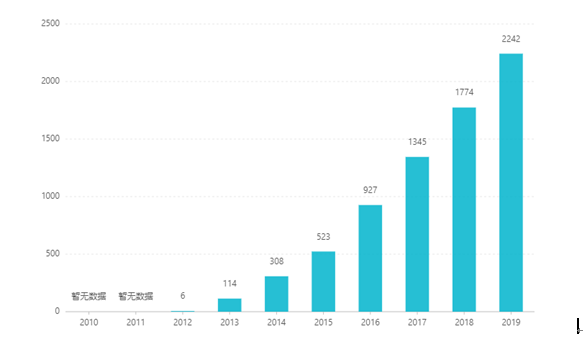
Siden børsnoteringen har salget økt år etter år, og nådde USD 2,242 milliarder i 2019. I Kina ble tablettdoseringsformen godkjent for markedsføring i mars 2017, og kom inn i medisinsk forsikringskategori B-katalogen gjennom forhandlinger i 2019. Den siste vinneren bud er RMB 26,79. Men på grunn av de høye tekniske barrierene for preparater med forsinket frigjøring, har denne doseringsformen ennå ikke blitt markedsført i Kina.
JAK kinase spiller en viktig rolle i betennelse, og dets hemmere har vist seg å behandle visse inflammatoriske og autoimmune sykdommer. Til nå har 7 JAK-hemmere blitt godkjent globalt, inkludert Leo Pharmas Delgocitinib, Celgenes Fedratinib, AbbVies upatinib, Astellas's Pefitinib, Eli Lillys Baritinib og Novartis's Rocotinib. Imidlertid er det kun tofacitinib, baritinib og rokotinib som er godkjent i Kina blant de ovennevnte legemidlene. Vi ser frem til Qilus "Tofatib Citrate Sustained Release Tablets" blir godkjent så snart som mulig og kommer flere pasienter til gode.
I Kina ble den opprinnelige forskningen tofacitib citrate godkjent av NMPA i mars 2017 for behandling av voksne RA-pasienter med utilstrekkelig effekt eller intoleranse mot metotreksat, under handelsnavnet Shangjie. I følge data fra Meinenet var salget av tofacitib-sitrat-tabletter i Kinas offentlige medisinske institusjoner i 2018 8,34 millioner yuan, som var langt lavere enn det globale salget. En stor del av årsaken er prisen. Det er rapportert at Shangjie sin opprinnelige utsalgspris var 2085 yuan (5mg*28 tabletter), og den månedlige kostnaden var 4170 yuan, som ikke er en liten byrde for vanlige familier.
Det er imidlertid verdt å feire at tofacitib ble tatt med i 2019 «Nasjonal medisinsk grunnforsikring, arbeidsskadeforsikring og fødselsforsikring medikamentliste» av Rikstrygdeverket etter forhandlinger i november 2019. Det meldes at månedsavgiften reduseres. til under 2000 yuan etter at priskuttet er forhandlet, noe som vil forbedre betraktelig tilgjengeligheten av stoffet.
I august 2018 gjorde Patent Reexamination Board ved Statens åndsverkskontor en revisjonsvedtak nr. 36902 anmodning om ugyldiggjøring, og erklærte kjernepatentet til Pfizertofatib, det sammensatte patentet, ugyldig på grunn av utilstrekkelig offentliggjøring av spesifikasjonen. Imidlertid vil patentet til Pfizertofatiib krystallform (ZL02823587.8, CN1325498C, søknadsdato 2002.11.25) utløpe i 2022.
Insight-databasen viser at, i tillegg til den opprinnelige forskningen, har fem generiske legemidler av Chia Tai Tianqing, Qilu, Kelun, Yangtze-elven og Nanjing Chia Tai Tianqing blitt godkjent for markedsføring i de innenlandske tofacitinib-tablettformuleringene. For tabletttypen med forsinket frigivelse var det imidlertid bare den opprinnelige forskningen Pfizer som sendte inn en markedsføringssøknad 26. mai. Qilu er det første innenlandske selskapet som har sendt inn en markedsføringssøknad for denne formuleringen. I tillegg er CSPC Ouyi i BE-prøvestadiet.
Changzhou Pharmaceutical Factory (CPF) er en ledende farmasøytisk produsent av APIer, ferdige formuleringer i Kina, som ligger i Changzhou, Jiangsu-provinsen. CPF ble grunnlagt i 1949. Vi har viet i Tofacitinib Citrate fra 2013, og sendt inn DMF allerede. Vi har registrert oss i mange land, og kan støtte deg med den beste dokumentstøtten for Tofacitinib Citrate.
Innleggstid: 23. juli 2021